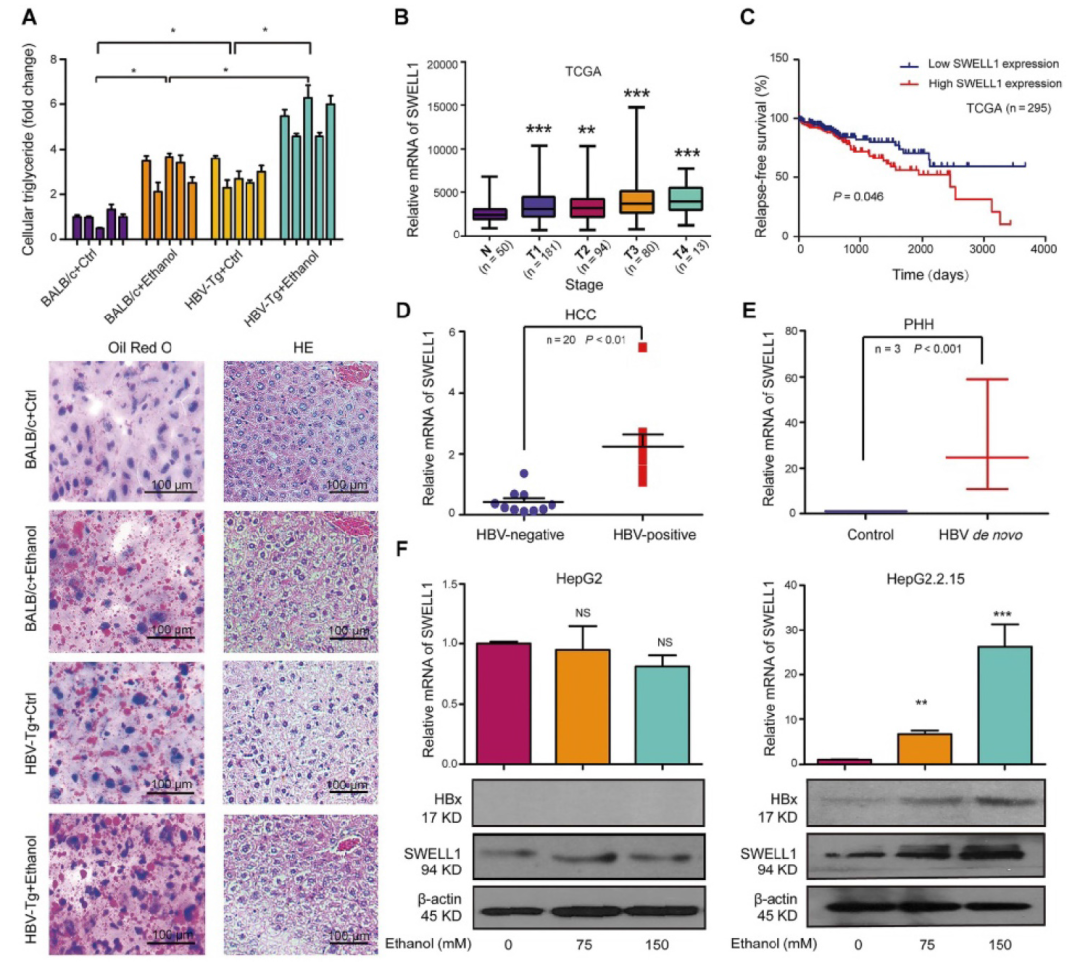
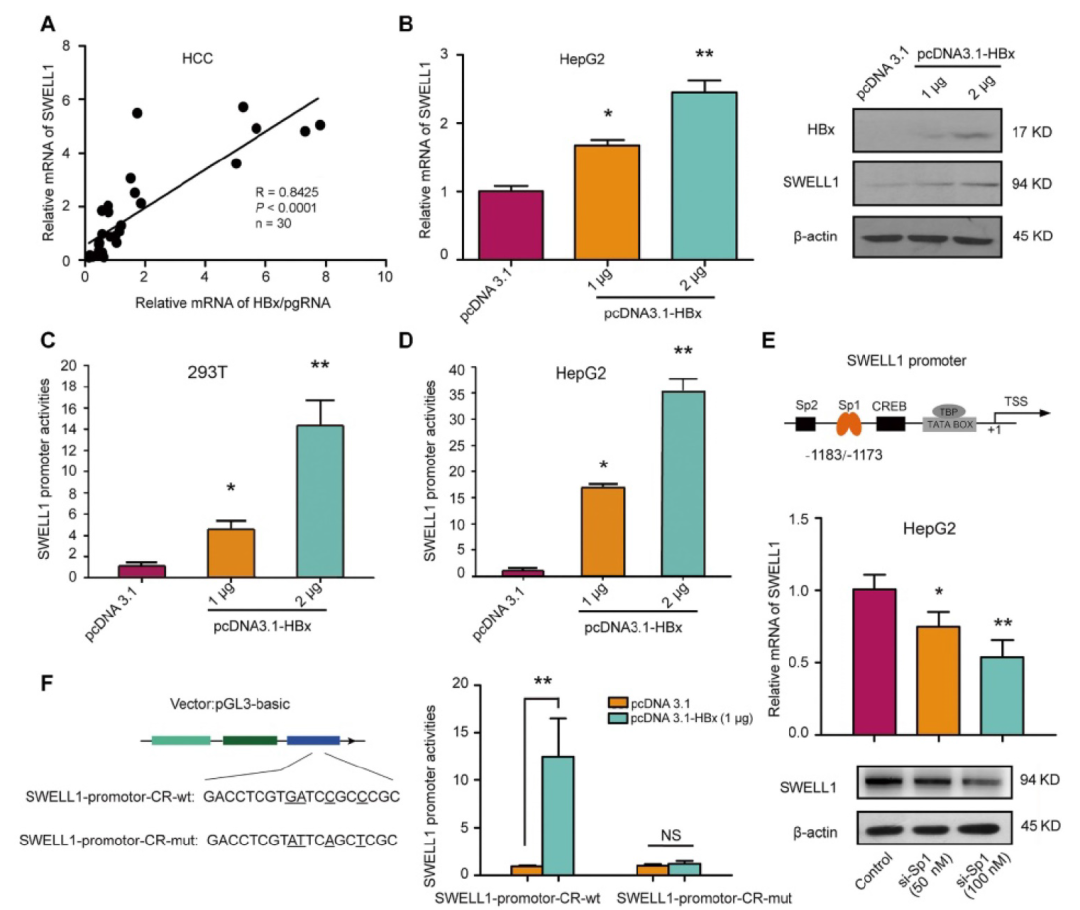
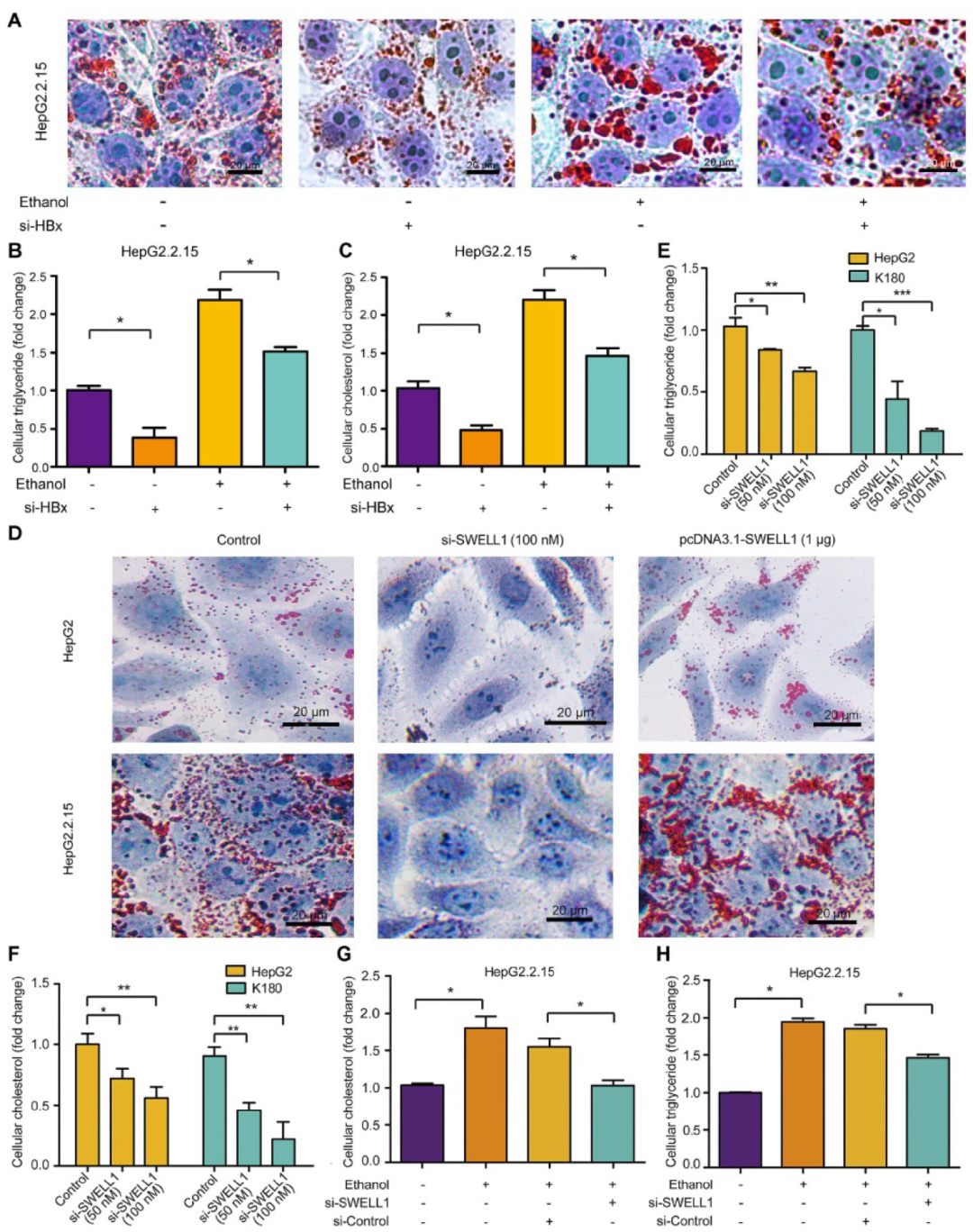
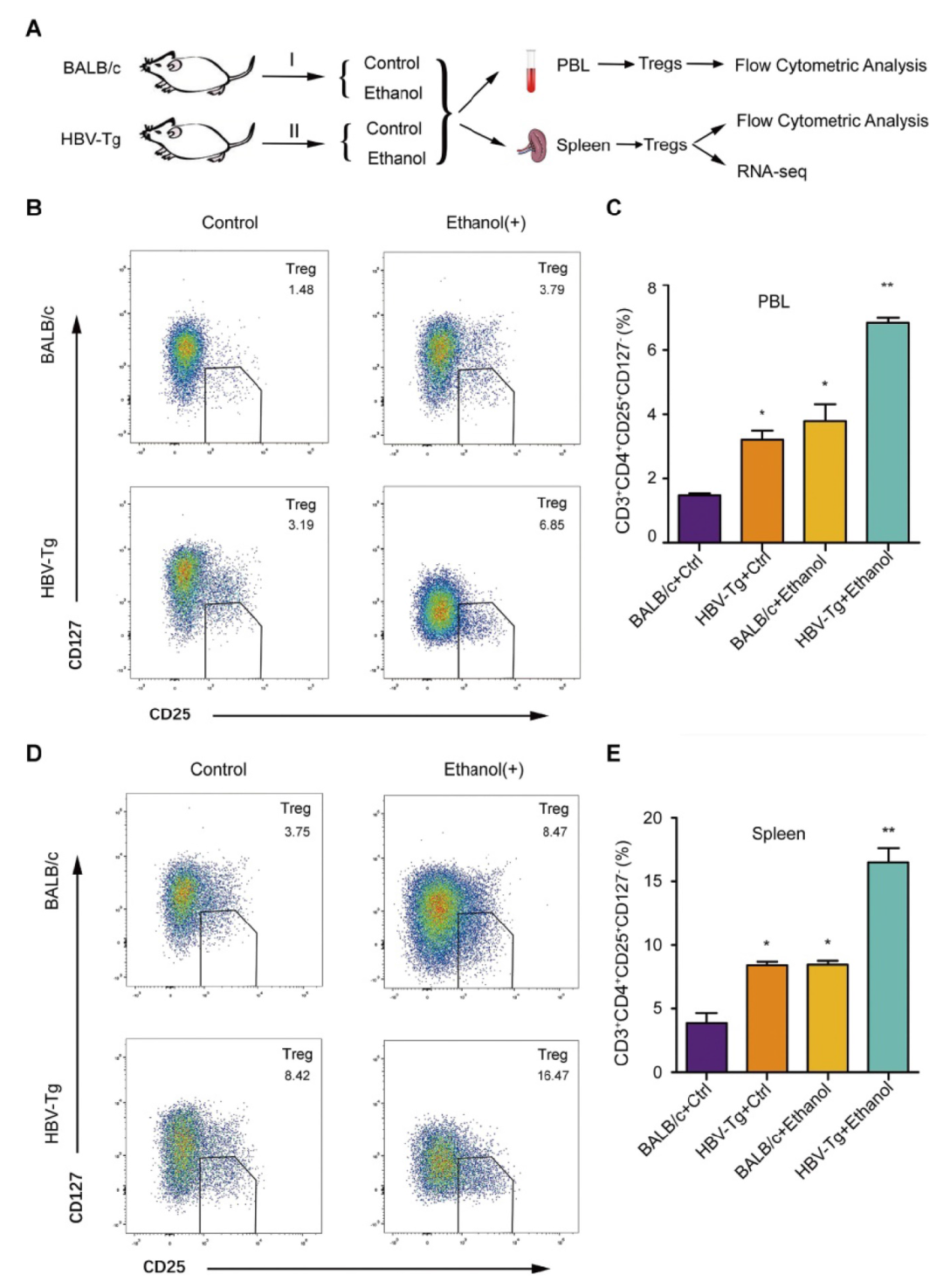
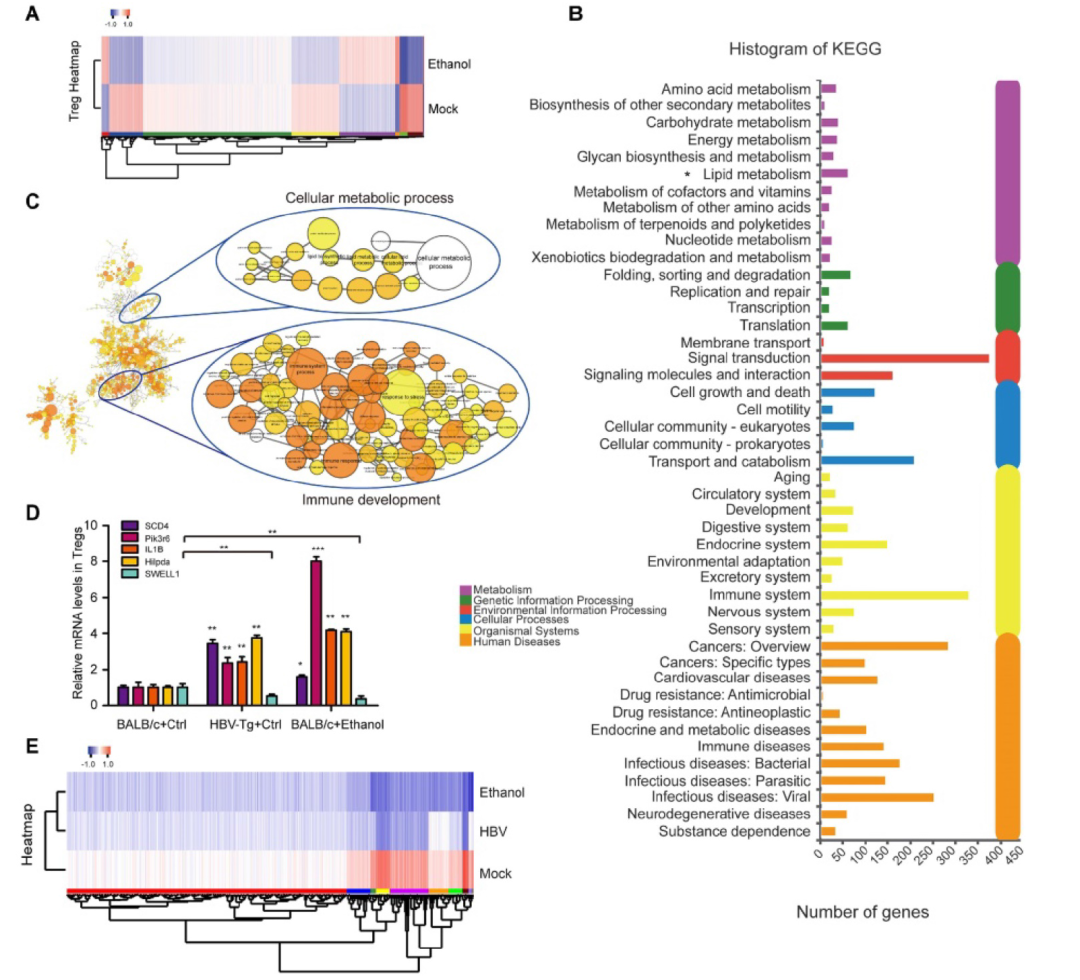
转载自 中华肝脏病杂志 酒精消费已成为世界范围内的公共卫生问题,它加速慢性乙型肝炎病毒(HBV)感染者的肝病进展。花生四烯酸代谢物前列腺素E2(PGE2)具有激活调节性T细胞(Treg)的功能。该研究利用HBV转基因小鼠及整合了HBV基因组的肝癌细胞系发现,长期摄入乙醇能够通过HBx/SWELL1/花生四烯酸信号加重HBV诱导的脂质代谢异常并激活HBV转基因小鼠Treg细胞。 苏木素-伊红(HE)染色及油红O染色显示,长期乙醇饲养的HBV转基因(HBV-Tg)小鼠肝细胞内脂滴明显增加,其肝组织甘油三酯水平相较正常饲养的HBV-Tg及乙醇饲养的野生型小鼠明显升高(图1A)。TCGA数据库分析显示,能够调节脂肪细胞胞内脂质含量的基因SWELL1(富含亮氨酸重复序列8A)高表达与原发性肝细胞癌(HCC)患者的不良预后相关(图1B-C);对临床样本中的SWELL1表达水平检测显示,相比于HBV阴性HCC患者,SWELL1在HBV阳性HCC患者的肝癌组织中表达量更高(图1D)。另外,SWELL1水平在HBV感染的原代肝细胞(PHH)中显著上调(图1E)。HBx在HCC脂质代谢异常中发挥重要作用,在乙醇干预后发现HBV稳定复制的HepG2.2.15细胞中HBx与SWELL1的mRNA及蛋白水平呈剂量依赖性升高,而在HepG2细胞中未见此现象(图1F)。 图1 乙醇通过HBx和SWELL1促进HBV诱导的异常脂质代谢。(A)上:四组小鼠肝脏组织中甘油三酯水平。下:油红O染色评估小鼠肝组织的脂质合成情况及HE染色评价肝脏组织病理学。(B)TCGA数据库中HCC患者SWELL1表达水平与疾病诊断相关分组(DRG)分析。(C)TCGA数据库中SWELL1低表达与高表达的HCC患者的无复发生存分析(n=295,P=0.046)。(D)通过RT-qPCR评估HBV阴性HCC及HBV阳性HCC组织中SWELL1的mRNA水平(n=20,P<0.01)。(E)以正常PHH为对照,利用RT-qPCR评估从头感染HBV的PHH中SWELL1的mRNA水平。(F)通过RT-qPCR和Western blot分析在乙醇剂量依赖性干预的HepG2及HepG2.2.15细胞中SWELL1的mRNA和蛋白水平。 在30例HCC患者癌组织中,SWELL1 mRNA表达水平与HBx/pgRNA正相关(图2A)。在HepG2及HepG2.2.15细胞中,HBx过表达上调了SWELL1的mRNA和蛋白水平(图2B)。此外,在293T及HepG2细胞中过表达HBx能够促进SWELL1启动子的激活且呈剂量依赖性(图2C-D)。以上结果提示,HBx能够在细胞转录水平上调SWELL1的表达。作者进而从TargetScan(http://www.targetscan.org/)获得了可能与SWELL1启动子区域结合的几种转录因子(图2E)。基于该实验室前期发现的HBx能够激活Sp1的实验结果,作者推测Sp1可能参与HBx对SWELL1的调节作用,并通过在HepG2细胞中利用siRNA敲减Sp1下调SWELL1的mRNA和蛋白水平加以验证(图2E)。 之后作者将SWELL1启动子中的潜在Sp1结合位点进行突变,进一步证实了HBx能够通过Sp1结合SWELL1启动子区进而从转录水平上调SWELL1的表达,当结合位点突变后该作用消失(图2F)。 图2 HBx通过共激活转录因子Sp1上调SWELL1表达。(A)通过RT-qPCR检测临床HCC组织中HBx/pgRNA与SWELL1 mRNA水平的相关性(n=30,R=0.8425,P<0.0001)。(B)通过RT-qPCR和Western blot评估HepG2细胞中SWELL1的mRNA和蛋白水平。(C-D)在pGL3-SWELL1-启动子及特定浓度的pcDNA3.1-HBx瞬时转染的293T及HepG2细胞中进行荧光素酶报告基因测定。(E)上:转录因子基因座模型表示SWELL1启动子的假定靶位点。下:在剂量依赖处理后,通过RT-qPCR和Western blot评估siRNA-Sp1转染的HepG2细胞中SWELL1的mRNA和蛋白水平。(F)左:分子构成模型表示SWELL1启动子核心序列(pGL3-SWELL1-promoter-CR-wt)和突变后的SWELL1启动子核心序列(pGL3-SWELL1-promoter-CR-mut)。右:荧光素酶报告基因测定瞬时转染了pGL3-SWELL1-promoter-CR-wt或pGL3-SWELL1-promoter-CR-mut的HepG2细胞中,过表达HBx对SWELL1核心启动子活性的影响。 接下来,该研究对乙醇调节细胞异常脂质代谢的潜在机制进行探讨。使用siRNA技术敲减HBx可在HepG2.2.15细胞中显著阻断乙醇介导的脂质堆积及甘油三酯和胆固醇水平的升高(图3A-C)。此外,油红O染色显示,敲减SWELL1可阻断HepG2和HepG2.2.15细胞的脂肪合成。相反,过表达SWELL1可增加胞内脂质堆积(图3D)。而通过siRNA技术敲减SWELL1可在HepG2和食管癌细胞系K180中显著降低甘油三酯和胆固醇水平(图3E-F)。进一步研究显示,siRNA-SWELL1能够在HepG2.2.15细胞中消除乙醇诱导的甘油三酯和胆固醇的增加(图3G-H),这表明SWELL1与乙醇诱导的细胞异常脂质代谢相关。 图3 乙醇通过HBx/SWELL1信号加重脂质代谢异常。(A)油红O染色检测乙醇、HBx siRNA或两者对HepG2.2.15细胞中脂滴的影响。(B)ELISA检测乙醇、HBx siRNA或两者对HepG2.2.15细胞中甘油三酯含量的影响。(C)ELISA检测乙醇、HBx siRNA或两者对HepG2.2.15细胞中胆固醇含量的影响。(D)油红O染色检测SWELL1 siRNA或pcDNA3.1-SWELL1对HepG2和HepG2.2.15细胞中脂滴的影响。(E)ELISA检测HepG2和K180细胞中SWELL1 siRNA对甘油三酯含量的影响。(F)ELISA检测HepG2和K180细胞中SWELL1 siRNA对胆固醇含量的影响。(G)ELISA检测HepG2.2.15细胞中乙醇、SWELL1 siRNA或两者对胆固醇含量的影响。(H)ELISA检测HepG2.2.15细胞中乙醇、SWELL1 siRNA或两者对甘油三酯含量的影响。 为了寻找SWELL1依赖的脂质代谢通路,作者在HepG2细胞中敲减SWELL1后进行RNA-seq检测。结果显示,敲低SWELL1后有651个基因表达上调,281个基因下调(图4A)。进一步的基因富集分析提示SWELL1可能通过花生四烯酸途径发挥作用(图4B)。对该途径关键基因的检测结果显示,SWELL1的过表达导致HepG2细胞中SCD1、GGT5、SCAP和PTGES2的上调,而转染siRNA-SWELL1的结果则与之相反(图4C)。 接下来,作者在小鼠模型中验证了长期乙醇摄入对HBx介导的SWELL1激活的影响。与其他三组相比,在乙醇饲养的HBV-Tg小鼠肝脏中,HBx和SWELL1的mRNA和蛋白水平显著增加(图4D)。同时,有乙醇摄入的HBV-Tg小鼠肝脏中花生四烯酸代谢产物PGE2的含量增加(图4E)。SWELL1在HepG2或K180细胞中过表达导致培养上清中花生四烯酸代谢产物PGE2增加,而转染siRNA-SWELL1的结果则与之相反(图4E)。临床HCC患者组织中SWELL1的表达水平与PTGES2、GGT5的表达水平显著相关(图4F)。这些结果提示SWELL1在体内和体外对花生四烯酸代谢信号具有调节作用。 图4 SWELL1在体内和体外调节花生四烯酸代谢信号。(A)热图显示HepG2细胞对照组和siRNA-SWELL1组RNA-seq检测后的层次聚类和差异基因分析。上调和下调的基因分别用红色和蓝色表示。(B)基因富集分析提示相比对照组,HepG2细胞siRNA-SWELL1组基因富集的途径和过程。(C)通过RT-qPCR检测HepG2细胞中SCD1、GGT5、SCAP、PTGES2和CPT1A的mRNA水平。(D)通过RT-qPCR和Western blot分析检测各组小鼠肝脏HBx和SWELL1的mRNA水平和蛋白水平。(E)上:ELISA检测各组小鼠肝脏中花生四烯酸代谢物PGE2的相对水平。下:ELISA检测HepG2及K180细胞的上清液中PGE2的相对水平。(F)通过RT-qPCR在30个HCC临床组织中检测了PTGES2、GGT5与SWELL1 mRNA水平的相关性。 为了进一步探究乙醇摄入对于HBV感染者免疫系统的影响,作者通过流式细胞术分析了HBV-Tg小鼠模型的外周血Treg细胞,实验包括四组:对照流质饮食的BALB/c小鼠、HBV-Tg小鼠和乙醇流质饮食的BALB/c小鼠、HBV-Tg小鼠(图5A)。流式细胞术分析结果表明,与正常小鼠相比,从乙醇饲养的BALB/c小鼠和HBV-Tg小鼠分离的外周血淋巴细胞(PBL)均有更高占比的CD3⁺ CD4⁺ CD25⁺ CD127⁻ Treg细胞(图5B)。乙醇饲养的小鼠(3.79%±0.89)或HBV-Tg小鼠(3.19%±0.49)中Treg占PBL总数的比例显著高于BALB/c小鼠(1.48%±0.11)。此外,相较于乙醇饲养BALB/c小鼠,乙醇饲养HBV-Tg小鼠中Treg的比例显著增加,从3.79%增加到6.85%(图5C)。同样,流式细胞术对脾脏Treg比例的分析结果表明,与正常小鼠相比,乙醇饲养的小鼠(或HBV-Tg小鼠)分离出具有更高比例的CD3⁺ CD4⁺ CD25⁺ CD127⁻ Treg细胞(图5D)。并且乙醇饲养的小鼠(8.47%±0.52)或HBV-Tg小鼠(8.42%±0.51)中Treg占总脾细胞的百分比显著高于对照组BALB/c小鼠(3.75%±1.22)(图5E)。这些结果提示,长期摄入乙醇可以使HBV-Tg小鼠的PBL和脾脏Treg比例增加。 图5 乙醇摄入会增加HBV-Tg小鼠的PBL和脾脏的Treg细胞。(A)研究慢性乙醇摄入对小鼠PBL和脾脏Treg影响的策略。(B、D)流式细胞术显示每组小鼠的PBL或脾脏中CD3⁺ CD4⁺ CD25⁺ CD127⁻ Treg细胞。(C、E)每组小鼠的PBL或脾脏中的Treg细胞百分比。 为了明确乙醇对Treg的影响机制,作者通过RNA-seq分析了脾脏Treg细胞的异质性。结果显示,与正常饮食的BALB/c小鼠相比,乙醇饲养的小鼠转录组可以找到4907个差异基因表达(图6A)。KEGG分析表明,HBV-Tg小鼠Treg中的差异基因可能在脂质代谢中起多种作用(图6B)。基因富集分析显示,乙醇饲养组上调基因主要富集在细胞免疫及代谢过程(图6C)。此外,研究还发现从HBV-Tg小鼠和乙醇饲养小鼠分选的Treg中,SCD4、Pik3r6、IL1B和Hilpda的表达水平显著增加,而SWELL1呈相反趋势(图6D)。SWELL1影响的基因之间的相互作用分析显示,SWELL1在T细胞发育和脂肪细胞代谢中可能发挥重要作用。 图6 小鼠长期乙醇摄入或HBV诱导的Treg细胞分析。(A)热图显示对照饮食和乙醇饲养小鼠脾脏Treg RNA-seq检测后层次聚类与差异基因分析。上调和下调的基因分别用红色和蓝色表示。(B)KEGG显示HBV-Tg小鼠差异基因富集的通路和过程。(C)乙醇摄入小鼠差异基因的GO富集分析。(D)通过RT-qPCR在对照、HBV-Tg和乙醇饲养小鼠的Treg中测定SCD4、Pik3r6、IL1B、Hilpda和SWELL1的mRNA水平。(E)热图显示SWELL1编码蛋白的层次聚类和差异基因分析。上调和下调的基因分别用红色和蓝色表示。 该研究通过使用HBV转基因鼠及具有HBV稳定复制的肝癌细胞模型,明确了长期乙醇摄入协同HBV通过肝脏中的HBx/Sp1/SWELL1/花生四烯酸信号通路共同诱发脂质代谢异常。同时,乙醇可能会提高外周血及脾脏驻留Treg细胞比例并促进其活化。总之,研究进一步明确了长期乙醇摄入和HBV感染对异常脂质代谢和Treg的协同作用。 慢性饮酒促进HBV感染导致的病变发展,是HBV研究领域的重大科学难题,受到国际前沿领域的广泛关注。本文通过应用HBV转基因小鼠模型,模拟临床乙肝患者饮酒,探讨了由乙醇和乙肝介导的肝脏异常脂代谢产物对免疫Treg细胞的作用,并深入研究了其分子机制。首次阐明乙醇可协同HBV通过促进肝脏异常脂代谢导致Treg细胞数量增多,提示在HBV促进肝癌发生的过程中由于乙醇介导Treg细胞数量的增多,致使免疫监控丧失,进而潜在地增加了肝癌发生的风险。本研究在动物整体水平上系统地观察了慢性酒精摄入条件下的肝脏脂代谢异常与免疫调节性T细胞功能的关系,将异常脂代谢与免疫调节性T细胞结合是其研究特色,两者的交叉研究为乙醇协同乙肝促进肝病进展提供了新理论。其在慢性饮酒协同HBV引发的异常脂代谢方面的创新成果,将进一步丰富乙肝领域的理论体系,并为今后开发抗乙肝药物提供新的作用靶点,具有重要的理论意义和实际应用价值。 文献来源: Liu Z, Wang J, Liu L, Yuan H, Bu Y, Feng J, Liu Y, Yang G, Zhao M, Yuan Y, Zhang H, Yun H, Zhang X. Chronic ethanol consumption and HBV induce abnormal lipid metabolism through HBx/SWELL1/arachidonic acid signaling and activate Tregs in HBV-Tg mice. Theranostics. 2020 Jul 23;10(20):9249-9267. doi: 10.7150/thno.46005. PMID: 32802190; PMCID: PMC7415795.